
近年来,国内电动轮椅出口欧盟的趋势呈现出稳步增长的态势。电动轮椅作为一种便捷的代步工具,在欧洲市场受到了广泛的关注和需求。欧洲国家对于辅助交通工具的需求量较大,且对产品的质量和安全性要求较高,这为国内电动轮椅出口提供了机会。同时,国内电动轮椅制造企业在技术研发和生产工艺上的不断提升,使得产品品质得到了有效提升。优质的产...

近期,由FDASUNGO从产品测试到技术文件编写全程辅导的宁波某企业手动轮椅FDA510K项目,从提交到获批仅历时2个月,便通过了FDA审核,产品可以合法合规的在美国市场自由流通! 7月,FDASUNGO又辅导一康复器械客户生产的代步车产品成功获批FDA510K。整个项目从受理到批准仅仅用时58天(注:官方数据库中此...

我国电动轮椅市场竞争激烈,为了提高公司效益,很多企业纷纷转向国外的市场,尤其是美国这样的发达国家,但是出口美国需要FDA510(k)认证,电动轮椅和手动轮椅在美国FDA当中是属于FDA510(k)的产品。下面我们就来看看电动轮椅、手动轮椅FDA510(k)认证办理流程。 电动轮椅、代步车等产品美国FDA510K申请流...

在欧洲市场上,牙科耗材的品质和安全性备受关注。为了确保质量和安全,欧盟委员会颁布了一系列严格的标准法规和指令,其中包括CE认证和ISO13485认证。 CE认证是欧洲市场通行的重要的认证标志,它是欧盟对制造业的强制认证标志。CE认证要求符合欧洲市场的技术要求和安全规定。对于牙科耗材来说,CE认证意味着该产品通过了欧...

过去2022年,我国境内康复医疗器械领域出口额为26.2亿美元,同比增长12.39%,且连续5年稳步增长。首先明确轮椅、拐杖、助行器、沐浴椅、病床等产品出口欧洲,在新欧盟医疗器械MDR法规下CE属于I类,属于低风险产品,管控相对要松一些。轮椅、拐杖、助行器、沐浴椅、手动病床制造商选择欧盟授权代表,完成CE技术文件和欧盟...

成人纸尿裤是一次性使用的纸类尿失禁用品,成人护理产品之一,主要适用于失禁成人使用的一种抛弃式的尿裤。成人纸尿裤的主要性能为吸水量,这主要取决于绒毛浆和高分子吸水剂的量。 成人纸尿裤、护理垫、卫生巾等产品CE、FDA认证优先FDASUNGO,FDASUNGO成功协助数十家护理用品获得CE、FDA认证注册,顺利出口欧美,...
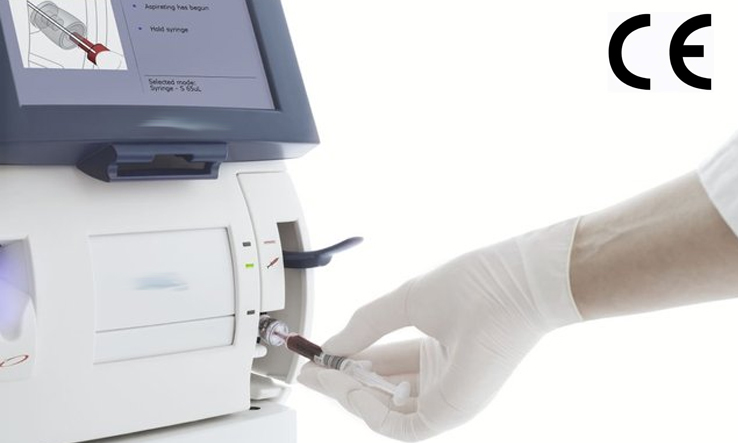
依据IVDR附录VIII分类规则Rule5,一般类的IVD仪器,例如:荧光免疫层析分析仪,酶免分析仪,PCR仪,NGS测序仪,自动核酸纯化仪,红细胞沉降率分析仪,化学发光免疫分析仪 ,全自动生化分析仪, 全自动血液细胞分析仪,尿液分析仪,血气分析仪等仪器在欧盟IVDR法规下,属于CLASS A类。 IVDR法规自202...

欧盟区是各医疗器械制造商及体外诊断(IVD)产品生产商的核心目标市场之一,而只有满足当地法规的要求,产品才能获得欧盟区市场准入资格。 医疗器械CE认证之体外诊断医疗器械IVDR分类: IVDR 2017/746号法规附录VII中详定7条规则,按医疗产品的风险程度,将产品分为Class A、Class B、Class C...
轮椅康复器械无论国内还是国外都属于医疗器械,毋庸置疑的,可以申请ISO13485认证。像牙刷、眼镜、牙科耗材、实验耗材等产品国外按医疗器械管控,国内没有分类,不属于医疗器械的,也能够办理ISO13485认证。 ISO13485为医疗器械制造商适配欧盟医疗器械指令(MDD),欧盟医疗器械法规(MDR)和其他法规的同时展...

为了确保产品可靠和用户安全,世界上主要经济体都制定了医疗器械市场准入的要求。 纵观所有的市场准入程序的设置框架,可以肯定的说产品检验检测在其中都至关重要。 按照欧盟MDR 2017/745/EU的规定,欧盟依据医疗器械的风险等级不同采取不同的合格评定路径来实现器械加贴CE标志,如图1所示。 普通I类( 灭菌、...

早孕试纸、验孕棒,在美国FDA数据库中产品代码是LCX。按其风险等级,属于II类产品,进入美国市场需要走510(k)申请路径。510K数据库显示,近年来,该代码产品国内企业获批k号显著增多。其中大都是通过美国咨询公司代理申报,仅有两家是由国内咨询公司辅导申报。这两家,均是由FDASUNGO公司辅导。FDASUNGO,目...
FDASUNGO荷兰公司已经为国内器械厂商成功申请IVDR CE注册证书。同时,FDASUNGO德国也已经受理部分厂商的IVDR CE注册申请。除了提供欧盟授权代表和注册服务,我们还提供IVDR技术文件编撰服务,帮助制造商全面规避合规风险。 1、哪些IVD属于Class A类呢?IVDR A类产品举例:荧光免疫分析仪...

FDA验厂即工厂检查,FDA下属美国专职负责药品、化妆品、医疗器械企业管理的政府机构,其根据FDA的授权,安排检查员到各企业进行工厂检查。 碘伏擦片、酒精洗手液、BZK擦片、止痒片、异丙醇擦片产品因为含活性成份,在美国按OTC药品管理,需要执行CGMP法规21CFR第211部分。如果检查中发现了严重缺陷,且对483表格...
成人纸尿裤、卫生巾、护垫、拉拉裤等产品出口欧洲、美国均按医疗器械管控,需要取得欧盟CE认证、美国FDA注册方可顺利出口。 成人纸尿裤是一次性使用的纸类尿失禁用品,成人护理产品之一,主要适用于失禁成人使用的一种抛弃式的尿裤。成人纸尿裤的主要性能为吸水量,这主要取决于绒毛浆和高分子吸水剂的量。 ...

FDA510K是美国FDA法规里面的一个章节,因其相应FD&C Act第510章节,故通常称510K注册,属于上市前通告。510K是医疗器械在美国上市的主要途径之一,绝大多数的II类医疗器械和部分I类、III类医疗器械通过此途径清关上市。1、510K一般步骤及注意事项:在FDA 510k数据库中找到比对器械:1...