FDASUNGO荷兰公司已经为国内器械厂商成功申请IVDR CE注册证书。同时,FDASUNGO德国也已经受理部分厂商的IVDR CE注册申请。除了提供欧盟授权代表和注册服务,我们还提供IVDR技术文件编撰服务,帮助制造商全面规避合规风险。
1、哪些IVD属于Class A类呢?
IVDR A类产品举例:
荧光免疫分析仪
核酸扩增检测分析仪
样本保存液、核酸提取试剂
病毒采样管、真空采血管
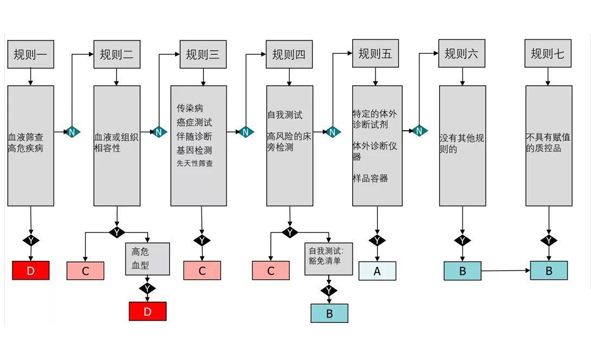
IVDR分类规则5提到了哪些产品属于Class A的IVD产品,同时欧盟还发布了IVD的分类指南文件。从其中可以看出如下三类器械属于Class A类的体外诊断设备。
a、一般实验室使用的产品、不具有关键特性的附件、缓冲液、洗涤液以及一般培养基和组织学染色剂。制造商将此类产品用于特定检查相关的体外诊断。
规则 5a 适用于一般实验室产品,如移液器、染色粉、显微镜玻璃载玻片、离心机、移液管吸头或仪器液体收集容器、缓冲液。如果制造商专门将此类产品用于体外诊断检查,则它们被视为 IVD 并适用于规则 5。
b、制造商专门用于体外诊断程序的仪器
规则 5b 适用于制造商专门用于体外诊断程序的仪器。这些仪器被归类为 A 类,而对应的试剂和试剂盒则根据自身特性进行分类。
c、标本容器
示例(非全部涵盖):真空或非真空管,空的或预装固定液或其他通用试剂,以保持生物标本的状态,用于运输、储存和收集体外诊断检查的目的。
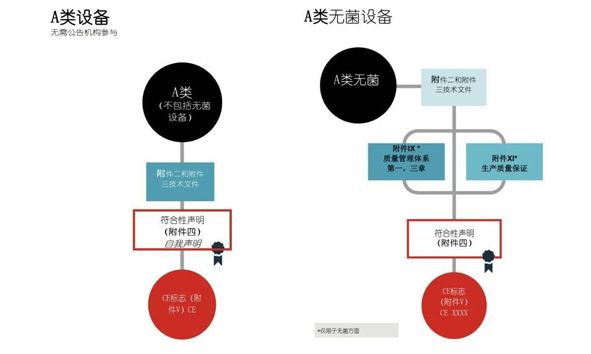
2、Class A 的IVD 加贴CE标记的模式
如下图2,如果A类IVD产品不是无菌状态交付的产品,那么通过符合性声明程序,指定欧盟授权代表并完成CE注册就可以加贴CE标志。
同时需要特别说明的是,对于A类IVD产品以无菌状态交付的,需要通过公告机构审核并获得EC认证证书之后,才能够提交欧盟授权代表完成CE注册。
3、IVDR 技术文件的要求
按照欧盟IVDR法规规定,其技术文件的结构通常需要包括如下内容。当然对于Class A类器械有部分要求不适用,需要在技术文件中进行识别。
除了上述的技术文件内容之外,IVDR也需要包括上市后监管体系的要求。
4、成功案例
FDASUNGO在8月11日已经为客户完成全套Class A产品技术文件并向欧盟主管当局递交IVDR的CE注册申请,并于8月24日获得批准。
大家知道,欧盟医疗器械法规开始实施已经有一段时间了,依据新的医疗器械法规要求,医疗器械如果要在欧盟上市销售,需要通过欧盟相关标准的检测,准备一整套技术文件,I(一)类以上产品还需要通过质量管理体系审核。
经常就会有客户来问,医疗器械CE技术文件到底包括哪些内容?那今天我们就来讲一讲新法规下技术文件的结构和内容要求。
依据法规附录2和附录3的要求,技术文件主要包括八大部分,分别是:
1. 器械说明与性能指标,以及对前一代或类似器械的引用。 具体包括产品介绍、产品分类、预期用途、适应症、禁忌症、UDI信息、器械原理、技术参数、附件及型号信息、图纸照片等十多项内容,此外还要对前一代产品或国际、欧盟市场上发现的类似器械进行描述。
2. 制造商提供的信息,这里是指制造商提供给用户的信息,包括产品的包装、标签以及产品说明书。
3. 设计与制造信息,需要对产品的设计与制造信息进行详细描述,包括设计阶段相关信息和文件,生产过程、验证及质量管控各个阶段的信息和数据,以及生产场地及供应商信息。
4. 通用安全与性能要求,通常是按照检查表的形式,按照法规附录I(一)的要求对产品通用安全和性能要求进行一一识别,适用的条款需要对符合性证据进行描述。
5. 风险利益分析和风险管理,主要是依据EN ISO 14971标准的要求制定风险管理计划和风险管理报告,进行风险利益分析、风险控制措施和风险管理结果的描述。风险管理是CE技术文件中的重点和难点之一。
6. 产品验证与确认,通常这个部分会包括产品生物学测试报告,安全性能测试报告,各种验证报告,临床评价或临床试验相关报告。如果产品涉及含药或来源于动物源,还会涉及到更多的要求。
7. 上市后监督相关文件,包括上市后监管计划和相应的监管报告,如PSUR等,产品风险越高,上市后监督的要求也越高。
8. 符合性声明
FDASUNGO荷兰公司已经为国内器械厂商成功申请IVDR CE注册证书。同时,FDASUNGO德国也已经受理部分厂商的IVDR CE注册申请。除了提供欧盟授权代表和注册服务,我们还提供IVDR CE技术文件编撰服务,帮助制造商全面规避合规风险。
- MDR认证
- 暂无标签