
什么是MDSAP? 以制定、管理并监督一种单一审核程序作为既定目标,MDSAP允许由获其认可的审核组织针对医疗器械制造商开展单一监督审核工作,满足不同管辖区域需求。 参与该项目的监管当局希望能够在众多审核组织之间提高一致性。 通过遵循MDSAP审核模式: l 将以协调一致的方式在众多审核组织内部开展MDSAP审...
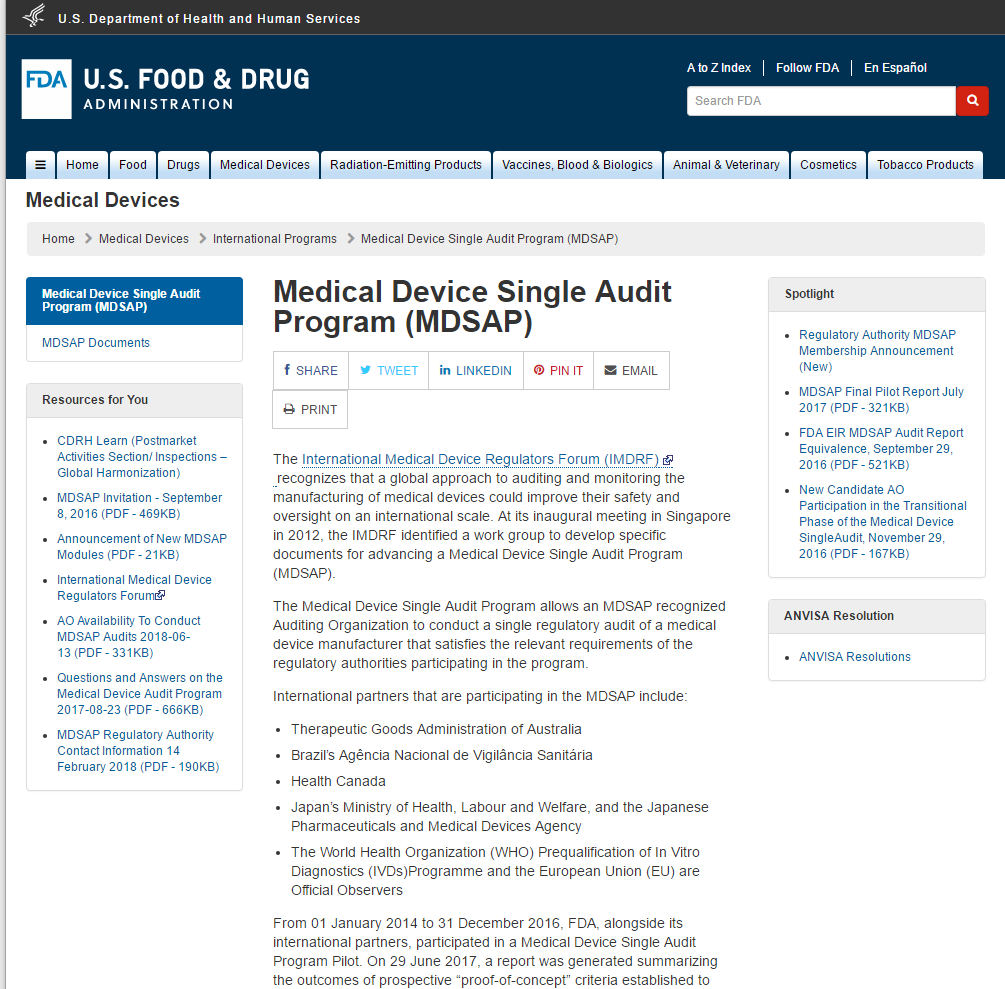
医疗器械单一审核方案(MDSAP)允许医疗器械制造商只接受一次质量管理体系审核,即可满足五个国家的标准和法规要求。这五个国家包括澳大利亚、巴西、加拿大、日本和美国。审核由具备五国监管机构(RA)授权的审核机构(AO)进行。 The International Medical Device Regulators Foru...
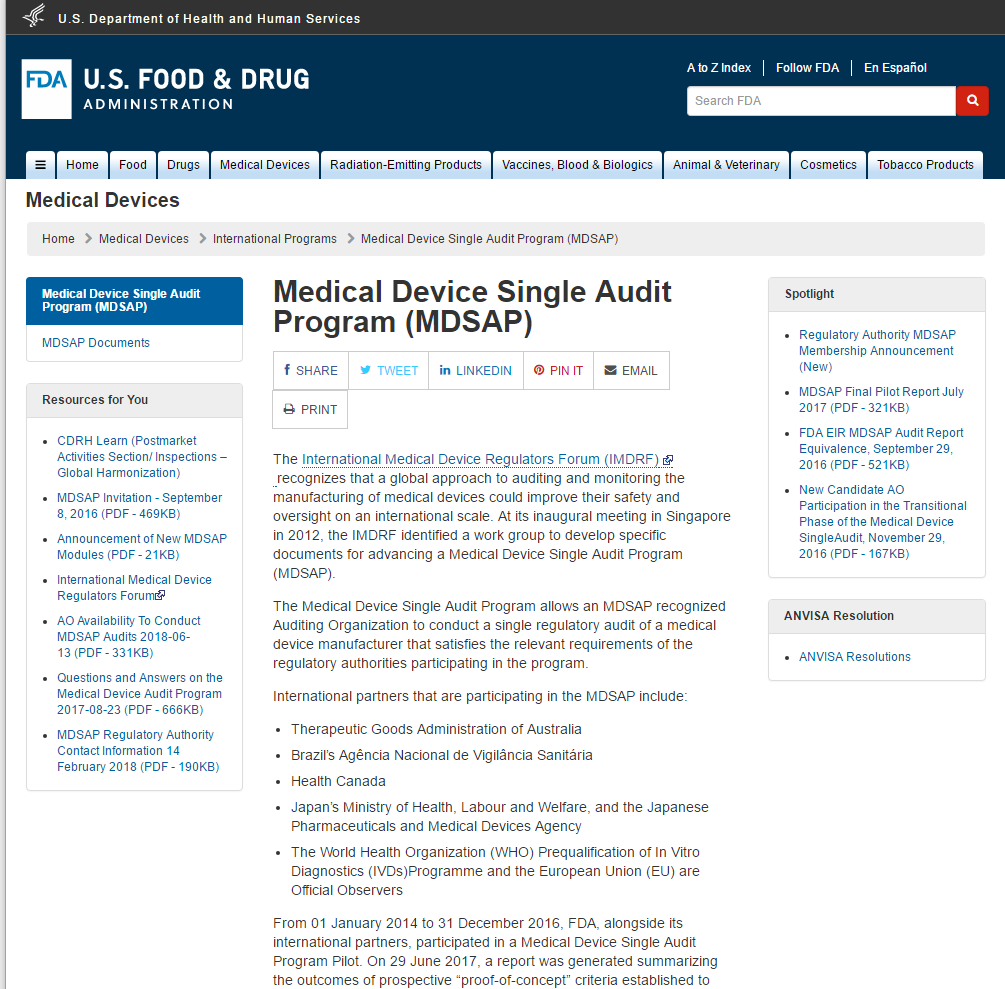
PART1 法规背景 医疗器械单一审核程序MDSAP(Medical Device Single Audit Program (MDSAP)是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起的项目。旨在由具有资质的第三方审核机构,对医疗器械生产商进行一次审核即可满足参与国不同的QMS/GMP要求。 该项目已经获得...

医疗器械单一审核程序MDSAP(Medical Device Single Audit Program (MDSAP)是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起的项目。旨在由具有资质的第三方审核机构,对医疗器械生产商进行一次审核即可满足参与国不同的QMS/GMP要求。 该项目已经获得五家监管机构美国...
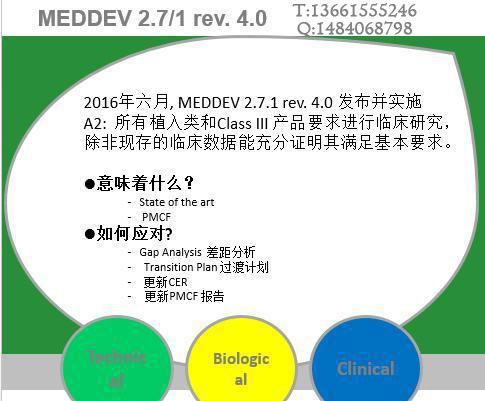
致各医疗医疗制造商: 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1第四版的大变化之一,就是证明“实质等同”的难度要比之前大很多。关...

FDA注册_FDA认证_FDA注册代理_FDA认证代理_FDA办理_上海FDASUNGO机构 一. FDA简介美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。作为一家科学管理机...

一、法规介绍 加拿大医疗器械由加拿大卫生部(Health Canada/HC)监管。加拿大医疗器械框架以Canada Medical Device Regulation(SOR/98-282/CMDR)为基础,同时又有指南文件对产品分类,产品注册,标签要求,官费支付等做了细致的规定和介绍。 二、器械分类 在加拿大,医...
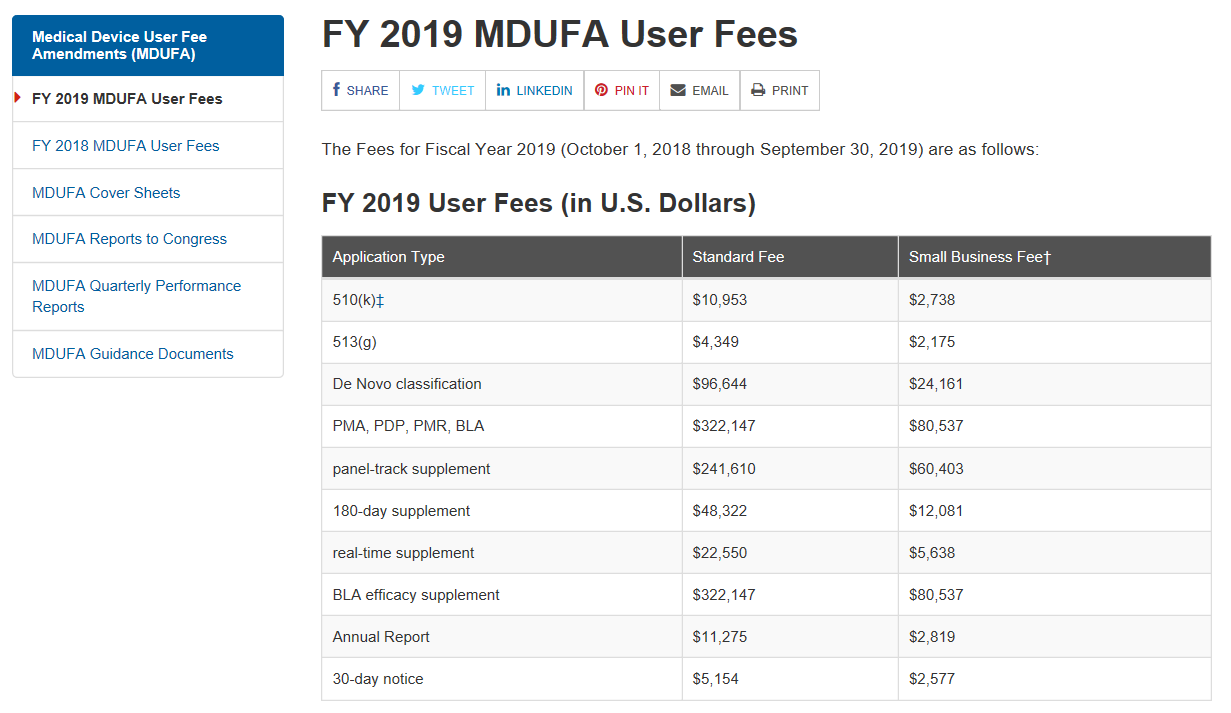
重点概要: 1)美国食品药品监督管理局(FDA)2019财政年医疗器械用户费用将增加约4%。 2)修订后的用户费用从2018年10月1日起生效。 3)与去年相比,最新的FDA医疗器械企业年度认证费增长幅度要小得多。 正文 美国FDA的医医疗器械注册用户费用包括510(k)和上市前批准(PMA)申请将在2019财年以比...

医疗器械FDA认证FDA对医疗器械的管理通过器械与放射健康中心(CDRH)进行的,中心监督医疗器械的生产、包装、经销商遵守法律下进行经营活动。 医疗器械范围很广,小到医用手套,大至心脏起博器,均在FDA监督之下,根据医疗用途和对人体可能的伤害,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,越高类别监督越多。如果产品是市场上不曾存在...

医疗器械CE标志 CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有C...

• 什么是临床评估报告? • 谁需要提交临床评估报告? • MEDDEV 2.7.1(第4版)是如何定义临床数据的? 临床评估报告(CER) 制造商如果打算在欧洲销售医疗设备,必须提供一个符合MEDDEV 2.7.1(第4版)和MDD或MDR 2017/745的临床评估报告(Clinical Evaluation ...
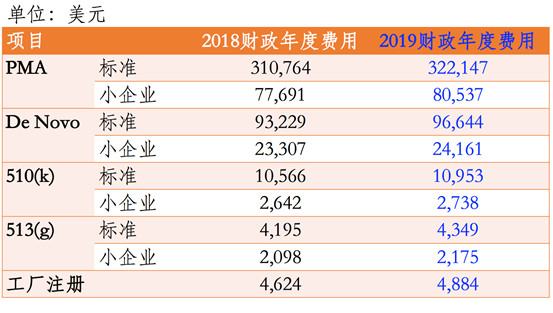
昨天(2018年7月30日)美国食品药品监督管理局(FDA)发布了联邦公报(83 FR 36598)公布了2019财政年度(2018年10月1日至2019年9月30日)医疗器械使用者费的费率。 根据医疗器械使用者费修正案IV的规定,2019财政年度FDA收取费用的总额为$190,654,875,考虑到通货...
CE第四版临床评价报告MEDDEV 2.7/1 Rev. 4编写,你想知道的都在这了! 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1...

前言 ISO13485 标准的诞生是和医疗器械法规紧密联系的。随着社会变革、经济发展,导致医疗器械产业的生产方式、组织形态千姿百态,社会公众对医疗器械安全有效提出了新的期望和需求。同时,鉴于此各国医疗器械法规的变化,国际标准化组织修订并2016年3月发布新版IS013485:2016(第3版)标准。次年1月我国发布等...

近两年,欧盟加强了临床评价和上市后监督的要求。2016年7月,医疗器械临床评估的全新指导文件MEDDEV 2.7/1第4版在欧盟委员会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的临床评价,以及如何证明数据和结论的科学有效性有了更明确的指导。这也给制造商带来了新的挑战。 该指南涉及9...